مقدمه
در علوم هفتم آموختیدکه همة مواد از اتم ساخته شده اند. اتم نیز از ذره های ریزتری به نام الکترون، پروتون و نوترون تشکیل شده است. این ذره ها مانند سایر مواد جرم دارند؛ به طوری که جرم پروتون بانوترون تقریباً برابر است. در حالی که جرم الکترون درمقایسه با دو ذرة دیگر بسیار ناچیز است. برخی از ذره های تشکیل دهندة اتم علاوه برجرم، بار الکتریکی نیز دارند. درجدول 1 بار الکتریکی و جرم این ذره ها به طور نسبی با هم مقایسه شده اند.
مدل های اتمی



الکترونها در کره ای از بارهای مثبت پراکنده اند.


در مدل بور تعداد الکترونهای هر مدار ثابت از مداری به مدار دیگر تغییر می کند.
مدل بور به مدل منظومة شمسی معروف است؛ زیرا ساختار اتم در این مدل بسیار شبیه منظومة شمسی است. همان طور که در منظومة شمسی سیارات به دورخورشید می چرخند، در مدل بور الکترون ها
در مسیرهای دایره ای به نام مدار به دور هسته درحرکت اند. شکل 2 ساختار اتم های هیدروژن، هلیم، لیتیم، بریلیم و بور را مطابق مدل بور نشان می دهد.

عنصرها و نشانه شیمیایی آنها
همان طور که می دانید، هر عنصر از اتم های یکسانی تشکیل شده است. از بین 118 عنصر شناخته شده، حدود 90 عنصر در طبیعت به شکل عنصر یا ترکیب وجود دارند. هر عنصر را با نشانه های شیمیایی
مشخصی نشان می دهند. برای نمونه عنصر هیدروژن را با نشانة H (بخوانید اچ) و عنصر نئون را با نشانة Ne نشان می دهند.
فرمول شیمیایی
از کنارهم قرار گرفتن نمادهای شیمیایی فرمول شیمیایی حاصل می شود.
مثلا H2 فرمول شیمیایی ئیدروژن، O2 فرمول شیمیایی اکسیژن، H2O فرمول شیمیایی آب، CH4 فرمول شیمیایی گاز شهری (گاز متان) و C12H22O11 فرمول شیمیایی شکر است.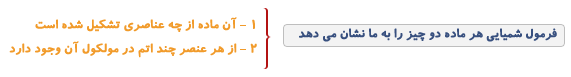
مثلا H2SO4 فرمول شیمیایی سولفوریک اسید است. این فرمول نشان می دهد که این ماده از سه عنصر ئیدروژن، گوگرد و اکسیژن تشکیل شده است و در هر مولکول آن دو اتم ئیدروژن،یک اتم گوگرد و چهار اتم اکسیژن وجود دارد.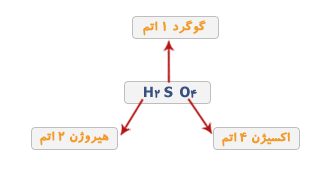
عدد اتمی (Z)
به تعداد پروتونهای هر اتم(به تعداد بارهای مثبت اتم)عدد اتمی می گویند برای مثال اتم سدیم 11 پروتون دارد,پس عدد اتمی سدیم11 است.عدد اتمی را گوشه پایین سمت چپ نماد شیمیایی می نویسند11Na
عناصر بر اساس افزایش عدد اتمی در جدول تناوبی مرتب شده اند بنابراین عدد اتمی مکان هر عنصر را در جدول تعیین می کند.
عدد جرمی (A)
به مجموع تعداد پروتونها و نوترونهای یک اتم عدد جرمی گفته می شود.
تمام اتمهای یک عنصر پروتونهای یکسان دارند اما تعداد نوترونهای آنها می تواند متفاوت باشد.

عدد جرمی در گوشه بالا و سمت چپ نماد شیمیایی نوشته می شود مثلا اتم کربن در هسته خود 6 پروتون و 6 نوترون دارد پس عدد جرمی آن 12 است. 12C
جدول تناوبی عناصر:
لیستی از کلیه عناصری است که تا کنون شناخته شده است این عناصر به ترتیب عدد اتمی در جدول مرتب شده اند در این جدول که بوسیله مندلیف دانشمند روسی تنظیم شده است در هر خانه جدول نشانه شیمیایی، عدد اتمی و عدد جرمی عنصر نوشته شده است در این جدول به هر ردیف افقی تناوب یا دوره می گویند.
تمامی عناصر یک دوره یا تناوب لایه های الکترونی برابر دارند در هر ردیف از چپ به راست خاصیت فلزی عناصر کاهش و خواص غیر فلزی افزایش می یابد.
ستونهای عمودی جدول تناوبی گروه نام دارد تمامی عناصر یک گروه در لایه آخر تعداد الکترونهای یکسان و خواص شیمیایی مشابهی دارند.در هر گروه از بالا به پایین خواص فلزی افزایش می یابد.
ایزوتوپ
نوک مداد از اتم کربن ساخته شده است. بررسی ها نشان داده است که اتم های کربنی که نوک مداد را تشکیل می دهند، دقیقاً یکسان نیستند. شکل 3 تعداد ذره های سازنده? هسته? اتم های کربن را نشان می دهد.
اتم های سازندة اغلب عنصرها مانند عنصر کربن دقیقاً یکسان نیستند. تعداد پروتون های این اتم ها یکسان است؛ اما تعداد نوترون های آنها متفاوت است. به اتم های یک عنصر که تعداد نوترون متفاوت دارند ایزوتوپ های آن عنصر می گویند. بنابراین عنصر کربن سه ایزوتوپ دارد.ایزوتوپ ها اتمهای یک عنصر هستند که در تعداد نوترون و در نتیجه عدد جرمی با هم تفاوت دارند اما عدد اتمی آنها یکسان است.
مثلا هیدروژن دارای سه ایزوپ است.
ایزوتوپ های یک عنصر خواص فیزیکی (جرم و چگالی) متفاوت اما خواص شیمیایی یکسان دارند(چون الکترونهای آنها برابر است)
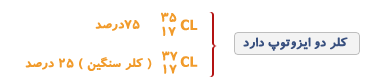
بیشتر عناصر، یک ایزوتوپ معمول و چند ایزوتوپ کمیاب دارند به ایزوتوپ های کمیاب تر ناخالصی های ایزوتوپی می گویند.
مثلا ایزوتوپ معمول ئیدروژن است که 9/99 درصد کل ئیدروژنهای موجود در طبیعت را شامل می شود. کمتر از 1/0 درصد را و مقدار ناچیزی را شامل می شود.
از بین ایزوتوپ های هیدروژن، ایزوتوپ ناپایدار است.
موادی که ایزوتوپ پرتوزا دارند، به ماده پرتو زا معروف اند.

پیوند میان اتم ها:
شاید از خود پرسیده باشید که چرا دستتان در آب فرو می رود اما در یخ فرو نمی رود؟ چرا بنزین فراٌر است اما قیر چنین نیست؟ چرا از ترکیب سدیم و کلر جسم سخت نمک طعام اما از ترکیب اکسیژن و ئیدروژن آب حاصل می شود؟
پاسخ اینگونه سوالات را در پیوند بین اتم ها جستجو کنید.

الف) پیوند کوالانسی
هر اتم تعداد معینی الکترون دارد که این الکترونها طبق نظریه بور در مدارهای متحدالمرکزی بدور هسته می چرخند. در مدار اول دو الکترون,در مدار دوم 8, الکترون و در مدارهای بعدی ..... قرار می گیرد حال اگر در مدار آخر کمتر از حد معمول الکترون وجود داشته باشد آن اتم میل ترکیب شدن با اتم های دیگر را دارد تا الکترونهای لایه آخر خود را تکمیل کند.

پیوند کووالانسی:
جاذبه ای است که اتمهای یک مولکول را کنار هم نگه می دارد.
در این نوع پیوند دو نافلز هر کدام با به اشتراک گذاشتن الکترون لایه آخر خود را کامل می کنند. الکترونهای اشتراکی به هر دو اتم تعلق دارد.
مثلا مولکول ئیدروژن 2 اتمی است. هر اتم ئیدروژن با به اشتراک گذاشتن تنها الکترون خود الکترونهای لایه خود را کامل می کند.
پیوند بین مولکولهای نیتروژن، اکسیژن، گاز متان ، الکل، کربن دی اکسید و ...... از نوع کووالانس است.
ب) پیوند یونی:
نمک خوراکی یکی از مهم ترین و پرکاربردترین مواد در زندگی و صنعت است. نمک خوراکی یک ترکیب است که از دو عنصر سدیم و کلر تشکیل شده است. در واقع فلز سدیم و گاز کلر در یک تغییرشیمیایی شرکت می کنند و به ماده? جامد و سفید رنگی به نام سدیم کلرید تبدیل می شوند.
در واکنش های شیمیایی فلزات تمایل به از دست دادن الکترون دارند در این صورت به یون مثبت یا کانیون تبدیل می شوند غیر فلزات هم مایل به گرفتن الکترون و تبدیل شدن به یون منفی یا آنیون هستند.
توجه داشته باشید که یون به اتمهای باردار گفته می شود. در یونها تعداد الکترونها و پروتونها برابر نیست. به مثالهای زیر توجه کنید:


کلمات کلیدی:
