تغییرات شیمایی در خدمت زندگی
«مواد در حال تغییر»
مواد پیرامون ما پیوسته در حال تغییرند . انجماد آب ، زنگ زدن آهن شکستن شیشه، ذوب یخ ، تغییر رنگ پارچه ها ، ترش شدن شیر، هضم غذا و ... از جمله تغییرات مواد هستند.
برخی از این تغییرات سودمند و برخی زیان آورند و ما پیوسته در پی آن هستیم که تغییرات مطلوب را پدید آوریم و از بروز تغییرات نامطلوب جلوگیری کنیم.
برای مثال پختن نان،تولید قند در برگ گیاهانtآزاد شدن انرژی در سلول ها مفید و سوختن نان،فاسد شدن شیر مضر هست.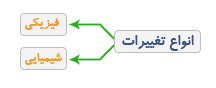
الف) تغییر فیزیکی: در این نوع تغییر شکل ، اندازه و حالت ماده تغییر می کند. اما خواص و ماهیت ماده تغییر نمی کند.
تبخیر، تصعید ، میعان و سایر تغییر حالت ها و نیز خرد شدن ، سائیدن و ... از جمله تغییرات فیزیکی هستند.
ب) تغییر شیمیایی: به تغییری گفته می شود که در نتیجه آن خواص و ماهیت ماده تغییر می کند و ماده یا موادی با خواص جدید حاصل می شود.
هنگامی که آب به کمک جریان الکتریسیته تجزیه می شود گازهای ئیدروژن و اکسیژن پدید می آیند این دو ماده هیچ شباهتی با آب ندارند.
سوختن چوب ، زنگ زدن آهن، تغییر رنگ پارچه ، زرد شدن برگ درختان ، هضم غذا، تبدیل شدن شیر به ماست و پنیر از جمله تغییرات شیمیایی هستند.
فعالیت: اگر چند قطره نیتریک اسید غلیظ بر روی فلز مس بریزیم گاز خرمایی رنگ نیتروژن دی اکسید که بوی تند و آزار دهنده ای دارد تشکیل می شود.
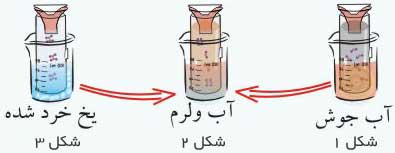
اگر لوله محتوی گاز نیتروژن دی اکسید را در آب جوش قرار دهیم رنگ قهوه ای پر رنگ ظاهر می شود(شکل1)
اگر لوله را سرد کنیم مولکول های سه اتمی نیتروژن دی اکسید به مولکول های 6 اتمی دی نیتروژن تترااکسید که بی رنگ است تبدیل می شود.(شکل 3)
اگر هر دو لوله را در آب ولرم قرار دهیم تعدادی از مولکول ها No2 و تعدادی N2o4 خواهند بود که در این صورت رنگ خرمایی کم رنگ مشاهده خواهد شد.
این تغییرات از نوع شیمیایی و برگشت پذیر هستند.
خواص ماده:
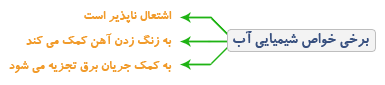
هر ماده دارای خواصی است که با آنها شناخته می شود مثلا بی رنگ بودن خاصه آب ، شور بودن خاصه نمک، اشتعال پذیر بودن خاصه کاغذ و تمایل به زنگ زدن خاصه آهن است.

الف) خواص فیزیکی:
به آن دسته از خواص گفته می شود که مشاهده و اندازه گیری آنها به تولید ماده جدید منجر نمی شود.
|
خواص فیزیکی |
رنگ |
بو |
چگالی |
نقطه ذوب |
نقطه جوش |
رسانایی (الکتریکی) |
|
آب |
بی رنگ |
بی بو |
1 |
صفر درجه |
100 درجه |
ناچیز |
ب) خواص شیمیایی :
به مجموعه خواصی گفته می شود که تمایل یا عدم تمایل یک ماده به شرکت در واکنش های شیمیایی را بیان می کند. مثلا اشتعال پذیری خاصه بنزین و عدم اشتعال پذیری خاصه آب است.
نشانه تغییر شیمیایی
هر تغییر شیمیایی با نشانه ای همراه است است. این نشانه حاکی از تشکیل یک ماده جدید می باشد البته باید توجه داشت که برخی از این نشانه ها در تغییر فیزیکی هم دیده می شوند.
برخی از نشانه های تغییر شیمیایی عبارتند از :
الف) ظهور یک رنگ جدید مانند:
رنگ قهوه ای ‹------------- قرار گرفتن میخ آهنی در محلول مس سولفات
رنگ آبی مایل به سیاه ‹------------- افزودن محلول ید به سیب زمینی
شیری رنگ ‹--------------- دمیدن در آب آهک
ب) تشکیل یک ماده جامد مانند:
ماده جامد پنیر مانند ‹------------- افزودن سرکه به شیر
ج) تشکیل حبابهایی از گاز
حباب های گاز کربن دی اکسید ‹------------ ریختن جوهر نمک بر روی پوسته تخم مرغ
حباب های گاز کربن دی اکسید+ نمک‹------------ جوش شیرین + ویتامین c
این واکنش به صورت زیر نیز می با
د: تولید گرما :
مانند حل شدن کلسیم کلرید در آب
همانطور که گفته شد برخی نشانه ها در هر دو نوع تغییر مشاهده می شوند.
مثلا هنگامی که در نوشابه گاز دار را باز می کنید و یا هنگامی که آب را حرارت می دهید هم حباب های گاز ظاهر می شوند اما در اینجا تغییر شیمیایی روی نداده است.
اجزاء یک تغییر شیمیایی
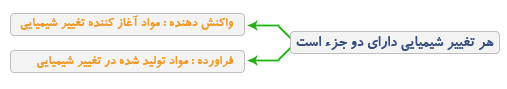
هنگامی که آهن در هوای مرطوب قرار می گیرد آهن با اکسیژن هوا ترکیب می شود و لایه قهوه ای یا نارنجی رنگ بر روی آن تشکیل می شود که زنگ آهن یا اکسید آهن نام دارد.
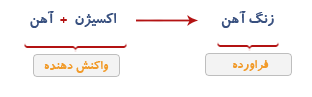
اگر فراورده واکنش فوق یعنی آهن اکسید با گاز ئیدروژن ترکیب شود دو ماده جدید یعنی آهن و آب پدید می آیند.
توجه: همیشه واکنش دهنده در سمت چپ واکنش و فراورده در طرف راست واکنش قرار دارد.

سوختن: نوعی تغییر شیمیایی است که طی آن یک ماده اشتعال پذیر که ممکن است یک ماده آلی مانند گاز شهری (متان) و یا یک نافلز مانند گوگرد و یا یک فلز مانند منیزیم باشد به سرعت با اکسیژن ترکیب می شود که نتیجه آن تولید انرژی (گرما و نور) همراه با ترکیبات اکسیژن دار است.
انرژی + بخار آب + کربن دی اکسید ‹----------------------- اکسیژن + گاز متان
انرژی + گوگرد دی اکسید ‹----------------------- اکسیژن + گوگرد
انرژی + منیزیم اکسید ‹----------------------- اکسیژن + منیزیم
سوختن:
سوختن مواد را باید کنترل کرد؛ زیرا در غیر این صورت، نمی توانیم از انرژی شیمیایی آزاد شده؟ آنها، به درستی استفاده کنیم. حتی گاهی ممکن است سوختن گسترش یابد؛ به طوری که کنترل آن از دست
ما خارج شود که در آن صورت خسارت های زیادی به بار می آورد. برای نمونه آتش سوزی در جنگل ها،
مزارع، کارخانه ها و … نتیجه؟ سوختن کنترل نشده است. به نظر شما چه عاملی )عواملی( سبب سوختن
می شود؟ چگونه می توان سوختن را کنترل کرد؟ چگونه می توان آتش را خاموش کرد؟ با ما همراه شوید
تا پاسخ این پرسش ها را بیابید.
تند(احتراق):
با نور و گرمای شدید همراه است مانند سوختن منیزیم و یا احتراق مواد منفجره
کند(اکسایش):
نور و گرمای محسوس ندارد. مانند اکسید شدن غذا در سلول های بدن- زنگ زدن آهن
بد نیست بدانید که گاهی بر اثر کمبود اکسیژن سوختن بصورت ناقص انجام می شود در این صورت علاوه بر کربن دی اکسید و بخار آب مقداری گاز سمی کربن مونوکسید (Co) هم تشکیل می شود.
اگر مقدار اکسیژن باز هم کمتر شود مقداری دوده هم تشکیل می شود . دوده شکلی از کربن است که بصورت گرد نرمی از سوختن ناقص مواد سوختنی حاصل می شود. از این فراورده فرعی سوختن، جهت تولید رنگ ، جوهر خودکار ، بارور کردن ابرها و نیز در صنعت لاستیک سازی استفاده می شود.
توجه داشته باشید که برای وقوع تغییر شیمیایی احتراق همواره سه شرط لازم است این سه شرط را در نمودار مقابل که به مثلث آتش معروف است می بینید.
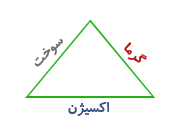
بدیهی است فقدان هر یک از شرایط از وقوع این تغییر شیمیایی جلوگیری می کند بنابراین هنگام ایجاد حریق به روش های مختلف:
یکی از این شرایط را حذف می کنند این روشها عبارتنداز :
الف) دور کردن مواد سوختنی از اطراف آتش (حذف سوخت) مثل بستن شیر گاز
ب) دور کردن (حذف اکسیژن) مثل ریختن ماسه و یا انداختن پتو بر روی آتش
ج) سرد کردن (حذف گرما) مثل پاشیدن آب بر روی آتش
فرآورده های سوختن
آموختید برای سوختن به ماده؟ سوختنی، اکسیژن و گرما نیاز است. به طوری که اگر یکی
از این سه مورد موجود نباشد، سوختن انجام نمی شود. برای مثال، شمع که از جنس پارافین است، درحضور شعله و اکسیژن می سوزد و گاز کربن دی اکسید، بخار آب، نور و گرما تولید می کند. این تغییرشیمیایی را به صورت زیر نشان می دهند:
گرما و نور + بخار آب + گاز کربن دی اکسید <..................گاز اکسیژن + شمع (هیدروکربن)
انرژی و تغییرات

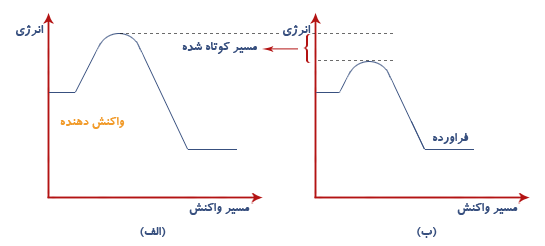
تغییرات گرماده : تغییراتی هستند که با از دست دادن انرژی بصورت گرما همراهند در این گونه تغییرات انرژی واکنش دهنده ها بیشتر از انرژی فراورده هاست.
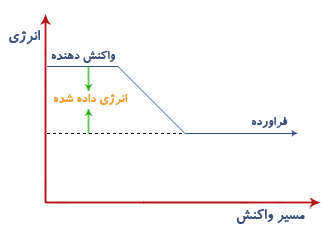
تغییرات گرماگیر: تغییراتی هستند که با گرفتن انرژی (گرما) همراهند در این تغییرات انرژی واکنش دهنده ها کمتر از فراورده هاست.
سرعت واکنش های شیمیایی : واکنش های شیمیایی با سرعت های متفاوتی انجام می شوند.
سرعت واکنش شیمیایی یعنی سرعت تولید فراورده ها و یا سرعت مصرف واکنش دهنده ها به بیان دیگر سرعت واکنش شیمیایی یعنی «تولید فراورده یا مصرف واکنش دهنده در واحد زمان»

توجه داشته باشید که هر چه انرژی فعال سازی (حداقل انرژی لازم برای شروع واکنش) کمتر باشد سرعت واکنش بیشتر است.

الف) دما :
آب از هیدروژن و اکسیژن تشکیل شده است . این دو گاز در دمای معمولی هرگز با هم ترکیب نمی شوند اما اگر مخلوط این دو گاز را تا حدود 700 درجه سانتیگراد حرارت دهیم بسرعت با هم ترکیب می شوند و آب پدید می آید.
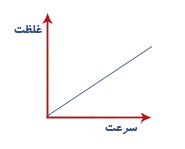
ب) غلظت :
با افزایش غلظت برخورد مؤثر بین مولکول های واکنش دهنده بیشتر و واکنش سریعتر می شود نمودار مقابل رابطه غلظت با سرعت را نشان می دهد.
ج) کاتالیزگر:
موادی هستند که سرعت واکنش های شیمیایی را افزایش می دهند اما خود دچار تغییر شیمیایی نمی شوند و در پایان واکنش دست نخورده باقی می مانند مثلا هیدروژن پراکسید (آب اکسیژنه) در گرما و نور به آب و گاز اکسیژن تجزیه می شود افزودن زنگ آهن سرعت تجزیه شدن را افزایش می دهد. اگر مقداری گرد دی اکسید منگنز به آب اکسیژنه اضافه کنیم سرعت واکنش بحدی افزایش می یابد که شروع به جوشیدن می کند و گرمای قابل ملاحظه ای ازاد می شود.(واکنش گرماده)
نمودار الف تجزیه این ماده بدون حضور کاتالیزگر و نمودار ب تجزیه این ماده با حضور کاتالیزگر را نشان می دهد.
د) سطح تماس:
با افزایش سطح تماس سرعت واکنش زیاد تر می شود به همین علت است که خاک اره سریعتر از تنه درخت می سوزد و یا خوب جویدن غذا هضم آن را آسانتر می کند.
فعالیت:
مقداری پر منگنات پتاسیم را روی تکه ای کاشی یا سنگ بریزید . چند قطره گلیسرین روی آن بچکانید و چند لحظه صبر کنید.
بار دیگر همین آزمایش را انجام دهید اما این بار قبل از چکاندن گلیسرین ، پرمنگنات را در هاون کاملا نرم کنید.
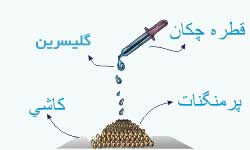
تفاوت نتیجه این مرحله با مرحله قبل را تفسیر کنید.
تذکر: این آزمایش را با احتیاط و زیر نظر بزرگتر ها انجام دهید.
تبدیل انرژی شیمیایی
1-تبدیل انرزی شیمیایی به الکتریکی:
با استفاده از تیغه های مسی و اهن و لیمو می توان لامپ LED را روشن نمود.
2- تبدیل انرژی شیمیایی به حرکتی:
مقداری قرص جوشان در قوطی فیلم عکاسی ریخته و درب قوطی را ببندید.
3- انرژی شیمیایی به نور و گرما:
یه باطری 9 ولتی را برداشته و روی مقداری سیم فلزی پشمی بکشید.
کلمات کلیدی: